Efnafræði
Frumeindakenningin
Grikkinn Demokrítus var uppi fyrir meira en 2000 árum, setti fram þá kenningu að efni væri búið til úr litlum eindum sem ekki var hægt að skipta í smærri eindir. Þessar eindir kallaði hann frumeindir eða Atóm. Grikkir gátu ekki sannreynt þessa kenningu og féll hún í gleymsku.
Hugmyndir um að allt efni væri gert úr 4 frumefnum: Jörð, vatni, lofti og eldi.
Englendingurinn John Dalton endurvakti svo þessa hugmynd um atómin í byrjun nítjándualdar og er hann talinn höfundur hennar í dag. Með rannsóknum sínum þróaði hann þá kenningu að: “All efni væri gert úr frumeindum (atómum) sem hallar væru eins í hverju frumefni um sig en mismunandi eftir frumefnum. Frumeindir mismunandi frumefna gætu síðan sameinast og myndað stærri eindir, sameindir.” Þessi kenning Daltons nefnist frumeindakenningin.
Frumeindir (atóm) og sameindir
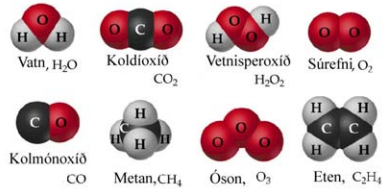
Efni eru búin til úr mjög litlum eindum sem kallast sameindir. Þessar eindir er hægt að kljúfa í frumeindir. Dæmi um sameindir eru vatn (H2O), sem eru tvö vetnisatóm og eitt súrefnisatóm.
Frumefnin eru rúmlega 100, en einungis 90 hafa fundist í náttúrunni en hin búin til í tilraunastofum. Frumefnum er raðað í lotukerfið.
Frumefni og efnasamband
Ef frumeindir efnis eru allar af sömu gerð kallast efnið frumefni.
Sameindir geta verið tvennskonar. Sumar þeirra eru úr frumeindum sem eru allar eins, t.d. óson (O3). En sumar eru samsettar úr ólíkum frumefnum. Hrein efni úr slíkum sameindum nefnast efnasamband, t.d. koltvíoxíð (CO2).
Efnaformúlur og byggingarformúlur
Efnaformúlur segja okkur úr hvaða efnum sameindir eru gerðar og í hvaða hlutföllum þau eru. Tökum vatn sem dæmi það hefur efnaformúluna H2O. Þessi formúla segir að það eru tvær vetnisfrumeindir (H) tengdar við eina súrefnisfrumeind (O). Litla talan aftan við skammstöfun frumeindar segir hversu margar slíkar frumeindir eru í efninu. Í sameindinni CO2 eru þá ein kolefnisfrumeind (C) og tvær súrefnisfrumeindir (O).
Byggingarformúla eru einföld teikning af líkani sameindar. Byggingar formúlur vetnis (H2) og súrefnis (O2) eru t.d.
H-H O=O
Strikin tvö sem tengja súrefnisatómin saman eru kölluð tvítengi.
Nöfn og tákn efnafræðinnar
Mál efnafræðinnar er alþjóðlegt og byggist oft á latínu. Mörg frumefni hafa þó líka séríslensk heiti. Nokkur algeng efni eru
| Grískt eða latneskt heiti | Frumeindatákn | Íslenskt heiti |
| Oxygen | O | Súrefni |
| Hydrogen | H | Vetni |
| Carbon | C | Kolefni |
| Nitrogen | N | Nitur |
| Sulfur | S | Brennisteinn |
| Phosforus | P | Fosfór |
| Chlorum | Cl | Kór |
| Natrium | Na | Natrín |
| Kalium | K | Kalín |
| Cuprum | Cu | Kopar |
| Ferrum | Fe | Járn |
| Calcium | Ca | kalsín |
Hamur efnis
Flest efni geta verið ýmist föst, fljótandi eða gas. Hamur, ástand, efnis við tiltekinn hita fer eftir bræðslu og suðumarki.
Fast efni er oft nefnt storka (storknun), fljótandi efni er vökvi og loftkennt efni lofttegund eða gas. Þegar efni breytir um ham er talað um hamskipti.
Útfrá frumeindakenningunni er kenningin um hreyfingu sameindanna dregin. Samkvæmt henni er hiti ekkert annað en mælikvarði á hreyfiorku sameindanna. Hár hiti í efni þýðir í raun að sameindir efnisins eru á mikilli hreyfingu. Lægsti mögulegi hiti, alkul (-273°C), felur í sér að sameindir séu alveg kyrrar. Engin takmörk eru á mesta hita.
Efnahvörf
Efnahvarf felur í sér myndun nýrra sameinda. Ef við hugsum okkur að tvö ímynduð efni A2 og B2 (hvarfefni) sem er blandað saman og þá hefst efnahvarf (blöndun efnanna sem hverfa og ný myndast). Efnin sem myndast gætu verið AB og AB (myndefni) .
Leysni efna
Mörg efni er hægt að leysa upp í vökvum. Við þetta blandast efnin (föst efni eða gös) vökvanum. Hæfileiki vökva til að leysa efni er nefndur leysni. Leysni fastra efna í vökvum eykst eftir því sem vökvinn er hitaður, hægt er að leysa meira af fasta efninu í vökvanaum. Leysni gasa, hinsvegar, minkar þegar vökvinn er hitaður, hægt er að leysa minna af gasinu í vökvanum. Þetta sést greinilega þegar vatn er soðið og loftbólur myndast í því þegar það hitnar.
Lífræn efni eru þau efni sem samanstanda af kolefni, vetni og oft einnig súrefni, nitri og/eða brennisteini og fleiri efnum.
Lofthjúpur jarðar
Efnasamsetning lofthjúpsins
Jörðin hefur lofthjúp sem er tugir kílómetra á þykkt. Hann er þéttastur við jörðu en þynnist eftir því sem lengra dregur frá jörðu. Efnin sem mynda lofthjúpinn eru
| Lofttegund | Efnaformúla | Hlutfall andrúmslofts (% rúmmáls) |
| Nítur | N2 | 78 |
| Súrefni | O2 | 20 |
| Koltvíoxíð | CO2 | 0,03 |
| Argon | Ar | 1 |
| Aðrar lofttegundir (m.a. vatnsgufa) | H2O | c.a 1 |
Bygging frumeinda
Öreindir
- 1.Róteind hefur eina plús hleðslu rafmagns (+)
- 2.Nifteind er óhlaðin og jafn þung og róteind
- 3.Rafeind hefur eina mínushleðslu (-) og einungis 1/2000 af massa róteinda og nifteinda.
Hleðsla einnar rafeindar eða róteindar nefnist frumhleðsla og er minnsta rafhleðsla sem til er. Róteindir og nifteindir eru í kjarna frumeinda en rafeindir sveima um hann. Vegna þess að frumeindir eru óhlaðnar hljóta þær að innihalda jafn margar róteindir og rafeindir.
Sætistala og massatala
Kolefnisfrumeind inniheldur 6 róteindir og 6 rafeindir. Sætistala frumeindar er jöfn fjölda róteinda í kjarna, sætistala kolefnis er 6. Hin ýmsu frumefni hafa mismundi sætistölu. Í lotukerfinu er frumefnum raðað eftir vaxandi sætistölu.
Fjöldi nifteinda í kjarna tiltekins frumefnis, t.d. kolefnis, er ekki alltaf sá sami. Til eru frumeindir af kolefni með 6,7, og 8 nifteindir. Slíkar mismunandi frumeindir sama frumefnis nefnast samsætur.
Samanlagður fjöldi róteinda og nifteinda í kjarna frumeinda er massatala
Af kolefni finnast þrjár samsætur í náttúrunni, með massatölurnar 12, 13 og 14. Kolefni 12 er algengast en kolefni 14, sem er geislavirk, er mikið notuð til aldursákvörðunar í jurta og dýraleyfum. Með því að mæla magn af kolefni 14 í tilteknu jarðvegssýni er hægt að segja til um aldur þess.
Samsætur frumefna hafa ólíkan fjölda nifteinda í kjarna og því mismikinn massa. Róteindafjöldinn breytist ekki.
Efnaeiginlekar frumefnanna eru háðir fjölda róteinda í kjarna og þar með fjölda rafeinda.
Fjöldi róteinda og rafeinda er alltaf sá sami ef frumeindin er óhlaðin.
Skýrari mynd af frumefni nr. 1 vetni
Vetnisfrumeind eru einfaldasta frumeind sem til er. Hún hefur aðeins eina róteind og eina rafeind. Sætistala vetnis er einn.
Rafeindir mynda rafeindaský utanum kjarnann. Í rafeindaskýi vetnis er aðeins ein rafeind.
Hvolfaímynd frumeindar
Við upphaf síðustu aldar (um 1900) var talið að rafeindir væru á tilteknum brautum um kjarnann. Þessi hugmynd er kennd við Danann Níels Bohr, sem var einn af brautryðjendum í kjarneðlisfræði
Bohr taldi að í vetnisfrumeindinni væri rafeindin á braut í tiltekinni fjarlægð frá kjarnanum. Þessi braut myndaði einskonar yfirborð kúlu. Frumefni með fleiri rafeindir hafa fleiri slík hvolf sem hvert um sig getur tekið tiltekinn fjölda rafeinda. Helín (He) hefur sætistöluna 2, 2 róteindir og 2 rafeindir. Báðar rafeindirnar eru á sömu braut um kjarnann, á sama hvolfi. Liþín (Li) hefur sætistöluna 3, 3 róteindir og 3 rafeindir. Þessar rafeindir raðast á 2 hvolf, á innra hvolfinu eru 2 rafeindir en þriðja rafeindin er á því ytra.
Hvert hvolf getur aðeins hýst tiltekinn fjölda rafeinda:
- 1.hvolfið getur hýst 2 rafeindir
- 2.getur hýst 8 rafeindir
- 3.getur hýst 8 rafeindir
Rafeindir á ysta rafeindahvolfi kallast gildisrafeindir.
Lotukerfið
Rússinn Mendelév settu fyrstur upp lotukerfið árið 1869. Hann raðaði efnum eftir vaxandi frumeinda massa og setti efni með líka eiginleka í sama dálk. Þegar Bohr hafði sett fram hvolfaímynd sína, varð ljóst hvers vegna efni í sama dálki. Þau hafa sama fjöld rafeinda á ysta hvolfi.
Dálkarnir (1-8) í lotukerfinu nefnast efnaflokkar en línurnar (1-7) nefnast lotur.
Eðallofttegundir
Frumefni í 8 efnaflokki eru kölluð eðallofttegundir. Þau eru öll loftegundir við stofuhita og eru einu frumefnin sem mynda alls ekki efnasambönd. Ástæðan fyrir þessu er sú að þau hafa rafeinda hvolf sín fullskipuð rafeindum og þar með verður tengigetan núll.
Myndun jóna
Í frumefni eru jafn margar rafeindir og róteindir og þess vegna er hún óhlaðin út á við. Sumar frumeindir geta þó losað sig við rafeindir og aðrar tekið við rafeindum. Þegar slíkt gerist ríkir ekki lengur hleðslujafnvægi innan frumeindanna. Þær verða annaðhvort plús (+) eða mínus (-) hlaðnar. Þetta kallast jónir. Jónir eru alltaf rafhlaðnar, plús ef róteindir eru fleiri en rafeindir og mínus ef rafeindir eru fleiri en róteindir.
Alþjóðlegt tákn fyrir rafeind er e– (e. electron).
Taki vetnisfrumeind við rafeind verður hún mínushlaðin H–
1. efnaflokkur Frumefnin líþín (Li) og natrín (Na) eru bæði í fyrst efnaflokknum og hafa því bæði eina rafeind á ysta hvolfi. Með því að missa rafeindir fá frumefnin jafn margar rafeindir á ysta hvolf eins og eðalgastegundirnar (utan vetnis)
2. efnaflokkur hafa tvær rafeindir á ysta hvolfi. Efnin geta auðveldlega látið þær frá sér, til að fá sama fjölda rafeinda á ysta hvolf og eðalgösin.
7. efnaflokkur Ef við færum okkur til hægri komum við að 7. efnaflokki. Taki þessi efni við rafeind fá þau jafn margar rafeindir á ysta hvolf og eðalgösin.
6. efnaflokkur þessi efni hafa 6 rafeindir á ysta hvolfi, þær taka 2 rafeindir til að öðlast 8 rafeindir á ysta hvolf.
Sölt eru efni gerð úr jónum. inniheldur bæði plús og mínusjónir og ná þannig hleðslujafnvægi. Venjulegt salt er úr jónunum Na+ og Cl–, og heitir því á fræði málinu natríumklóríð. Jafn mikið er af hvorri jón. Í föstum ham slíkra efna raðast jónirnar reglulega upp, plús og mínusjónir til skiptis. Við þetta myndast kristallar með reglulegri lögun. Slík efni hafa átt bræðslumark. Efna formúla saltsins er NaCl.
Sýrur og basar Sameiginlegt einkenni allra sýra er súrt bragð. En sýrur hafa fleira sameinginlegt, t.d. breyta þær lit á tilteknum efnum sem nefnast litvísar og eru notaðir til að athuga sýrstig efna. Ástæða þeirra áhrifa sem sýrur hafa er sú að þær eru neikvætt rafhlaðnar (jónaðar) og gefa því auðveldlega frá sér rafeindir. Basar eru andstæðan við sýrur, þeir eru líka jónaðir en jákvætt, þ.a. þeir taka til sín rafeindir. Ef sýru og basa er rétt blandað saman verður útkoman óhlaðin, þ.e. hvorki sýra né basi.
Afoxun verður þegar efni tekur til sín rafeindir. Oxun verður þegar efni gefur frá sér rafeindir.
Sýrustig er mælt í pH gildum. pH gildið 7 er talið hlutlaust en há pH gildi eru basísk á meðan lág pH gildi eru súr.
Málmar 4/5 hluti allra frumefna eru málmar. Þeir spanna marga flokka lotukerfisins, auk þess að frumefnin í miðju lotukerfinu eru allt málmar.
Fáir málmar finnast óbundnir (sem frumefni) í náttúrunni. Ástæðan er sú að óbundnir hvarfast þeir m.a við súrefni loftsins. Frá þessu eru eðalmálmar þó undantekning, t.d. gull og platínum. Langflestir málmar finnast í náttúrunni í málmsöltum. Þessi efnasambönd hafa allt aðra eiginleika en málmarnir óbundnir, t.d. vantar málmgljáann og rafleiðnina.
Málmar mynda málmkristalla. Eitt megin einkenni málma er rafleiðni sem byggist á því að rafeindir eiga greiða leið í gegnum hluti úr málmi. Skýringin á þessu er sú að rafeindir málma eru mjög laust bundnar og eiga auðvelt með að láta þær frá sér.
Málmleysingjar eru frumefnin hægra megin í lotukerfinu með sameiginlega eiginleika, atóm málmleysingja mynda sameindir þegar þau tengjast saman með samgildum tengjum.



 Þegar öllu þessu er lokið….. þá getið þið kíkt á
Þegar öllu þessu er lokið….. þá getið þið kíkt á